Что такое химическая коррозия и как ее устранить?
Содержание:
- Меры защиты от электрической коррозии
- Смесь «Уризол»
- Искусственное старение
- Основные виды коррозии
- Удаление коррозии – шпаклевки
- Технический прогресс в развитии методов борьбы с коррозией
- Олово и цинк. «Опасные» и «безопасные покрытия
- Почему коррозия называется коррозией?
- Классификация видов коррозии
- Коррозия неметаллических материалов
- Применение ингибиторов коррозии
- 1 Немного информации о коррозии металла
- Экономический ущерб от коррозии
- Ржавеют… все!
- Есть ли надежда?
- Что такое коррозия
- Виды коррозии бетона
- Методы защиты от коррозии металлов
Меры защиты от электрической коррозии
Для предотвращения этого типа коррозии используются способы электрической защиты кабеля, которые также применяют и для защиты от химической коррозии.
Суть электрической защиты заключается в подаче отрицательного потенциала на металлическую оболочку кабеля, что позволяет прекратить на ее поверхности электролитические процессы.
Электрическую защиту подразделяют на три типа:
- катодная;
- протекторная;
- дренажная.
При катодной защите земля работает как катод. Между оболочкой кабеля и грунтом при помощи специальной катодной станции прикладывается разница потенциалов, что приводит к возникновению постоянного тока. Его протекание от почвы на кабель обеспечивает поляризацию.
Протекторная защита от коррозии не требует использования внешнего источника поляризационного тока. В качестве него используется гальванический элемент, который формируется металлической оболочкой кабеля («катод») и специальным металлическим элементом («анод»). Между ними в среде электролита возникает разница потенциалов. В результате протекания поляризационного тока происходит реакция восстановления металла кабельной оболочки и окисления протектора. Для защиты металлической оболочки кабелей от коррозии в зоне действия блуждающих токов промышленной частоты используются не обычные, а поляризованные протекторы. Их особенностью является подключение к кабельной оболочке через диод.
Электрический дренаж — это способ защиты кабеля от коррозии, предусматривающий отвод блуждающих токов при помощи проводника. Дренажный проводник подключается к металлической оболочке кабеля в центральной части анодной зоны, где накапливается наиболее значительный потенциал по отношению к земле. По этому проводнику блуждающие токи отводятся к минусовой шине подстанции или к рельсам.
Смесь «Уризол»
Смесь “Уризол” следует рассмотреть отдельно, так как ее используют для покрытия трубопровода. Также она подойдет для фитингов, соединительных деталей, крановых узлов и тех изделий, которые постоянно контактируют с нефтью или газами. Данный состав нужен для того, чтобы избавиться от влияния подземных и атмосферных воздействий. Нередко данная смесь также применяется для изоляции бетонных материалов. Данное вещество наносится очень просто, без какого-либо труда. Для того чтобы обработать поверхность, необходимо использовать распылитель. Только так можно избежать коррозии металлов и сплавов подобных изделий. Как только компоненты соединяются, начинается реакция. Из-за этого возникает полимочевина. После этого смесь переходит в гелеобразное и нетекучее состояние, а после некоторого времени становится твердой. Если скорость полимеризации будет медленной, то начнут образовываться подтеки. Они вредные, так как из-за них трудно наращивать толщину покрытия. Нужно заметить, что эта смесь долгое время сохраняет липкое состояние. За счет этого все слои будут максимально равномерными, а промежуточные замеры толщины сравняются между собой. Если процесс полимеризации будет слишком быстрым, то адгезия состава уменьшится. При этом толщина получаемого слоя для изоляции будет неравномерной. К слову, распылительный пистолет быстро засоряется, если скорость покрытия слишком быстрая. Факторы коррозии металлов не будут появляться, если сделать все верно. Для того чтобы предупредить подобные ситуации, необходимо тщательно подбирать компоненты и соблюдать правила изготовления.

Искусственное старение
Процесс коррозии не всегда имеет разрушительное влияние и приводит в негодность определенные материалы. Нередко из-за коррозии у покрытия появляются дополнительные свойства, необходимые человеку. Именно поэтому популярным стало искусственное старение. Чаще всего его применяют, если речь идет об алюминии и титане. Только при помощи коррозии можно добиться повышенной прочности материалов. Для того чтобы завершить процесс разрушения правильно, необходимо использовать термическую обработку. Учитывая, что естественное старение материалов в некоторых условиях довольно медленный процесс, то не нужно уточнять, что при использовании этого метода материал должен иметь специальную закалку. Нужно также понимать все риски, которые связаны с данным методом. Например, хотя и прочность материала повышается, но пластичность максимально уменьшается. С легкостью теперь читатель сможет ответить на вопрос о том, что такое коррозия металла искусственного типа.
Основные виды коррозии
Коррозионные процессы классифицируют по нескольким параметрам, а конкретные типы коррозии различают по некоторым признакам. Ниже вы узнаете, по каким факторам классифицируют коррозию, и что такое, например, химическая коррозия.
Классификация по механизму протекания процессов
Химическая коррозия – процесс контакта элемента металла со средой, способствующей развитию коррозии, во время которого реакция окисления металлического элемента и восстановления самой окислительной компоненты среды происходит одновременно.
Электрохимическая коррозия – механизм реакционного соприкосновения раствора электролита с металлом, сущность которого, в противовес химическому типу ржавления, заключается в процессе, когда атомы металла ионизируются, окислительная компонента среды восстанавливается не в едином пространственном и временном промежутке: скорость реакций обусловлена электродным потенциалом.
Классификация по виду коррозионной среды и условиям
Газовая коррозия – реакция ржавления металлов в условиях газовой среды с минимально допустимым содержанием воды (коэффициент не выше 0,1%) либо с применением экстремально высоких температур. Газовая коррозия популярна в промышленных сферах: нефтехимической, а также химической отраслях.
Подземная коррозия – ржавление в грунтовой среде.
Атмосферная коррозия — ржавление металлов в воздухе либо влажном газе.
Биокоррозия – реакция с появлением ржи под воздействием микроорганизмов.
Контактная коррозия – при подобной реакции участвует несколько металлов с отличными друг от друга потенциалами по электролиту.
Радиационная коррозия – возникновение ржи под влиянием радиоактивных лучей.
Коррозия током – процесс коррозии происходит в условиях воздействия внешнего либо блуждающего тока.
Коррозия под напряжением – ржавление металла в коррозионной среде под механическим напряжением. Химия подобного вида ржи небезопасна, в главной мере для опорных конструкций с воздействием механических нагрузок на них (турбины, рессоры, ведущие оси строений). Немаловажным нюансом при обозначенном типе ржавления служит потенциальная коррозионная усталость – накопительный эффект возникает при периодичном растягивающем напряжении.
Коррозионная кавитация – разрушительное влияние на металл коррозионной среды и ударной силы.
Фреттинг-коррозия – разрушение металлических поверхностей единовременным воздействием благоприятной для ржи среди и вибрации. По проявлению результатов процесса ликвидировать следствие возможно, для этого потребуется четко подобрать структурный материал, снизить уровень трения, применить покрывающую пленку либо выполнить другие подходящие в таком случае действия.
Межкристаллитная коррозия – проявление ржи по граням вкраплений. Так называемое скрытный разлом, в период активности которого внешних признаков не заметно, однако металл в краткие сроки лишается свойств прочности и эластичности. Наиболее часто от подобного вида внешнего вмешательства страдают сплавы, в состав которых входят никель, алюминий, хром.
Щелевая коррозия – является причиной повреждения металла в резьбовых креплениях, между прокладками и аналогичных участках.
На видео: всё о электрохимической коррозии.
Классификация по типу коррозионной деструкции
Сплошная коррозия – ржавчине подвергается поверхность целиком. Различают несколько подтипов:
- Равномерная (поверхностная коррозия) – ржа проявляется одновременно по захваченной процессом территории. Пример – разрушение железных труб на открытом воздухе.
- Неравномерная – скорость реакций на отдельных участках общей территории варьируется.
Избирательная коррозия — ржавеет один из компонентов сплавов или обособленная структурная секция (например, реакция обесцинкования латуни).
Местная коррозия — разрушению подвергаются сепаратные пятна целостного объекта. Проявление наблюдается в форме отдельных вкраплений поврежденностей, проникнувших на малую глубину слоя металла (ржа по латуни в соленой морской воде); значительных углублений в виде раковин (сталь, закопанная в почву); обособленных точек, именуемых питтингами, входящих в толщу металла на серьезную глубину (хромовоникелевая сталь аустенитного класса).
Удаление коррозии – шпаклевки
Когда коррозия металла достигает своей максимальной активности, место поражения обрабатывается преобразователями ржавчины, что способствует разрыхлению поврежденных областей. В результате, это место можно легко почистить механическим способом и заполнить специальными шпаклевками по металлу. Обрабатывая шпаклевкой листовой металл, скрываются не только видимые повреждения, но и заполняются микротрещины, неровности, сколы и пр. Шпаклевки можно наносить, как на грунтовки, так и на чистый металл, при этом данный материал очень хорошо сочетается с любыми лакокрасочными покрытиями.

Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Олово и цинк. «Опасные» и «безопасные покрытия
Возьмем еще пример. Допустим, кузовная панель покрыта оловом. Олово — очень стойкий к коррозии металл, кроме того, оно создает пассивный защитный слой, ограждая железо от взаимодействия с внешней средой. Значит, железо под слоем олова находится в целости и сохранности? Да, но только до тех пор, пока слой олова не получит повреждение.
А когда такое случается, между оловом и железом тут же возникает гальваническая пара, и железо, являющееся более активным металлом, под воздействием гальванического тока начнет корродировать.
Кстати, в народе до сих пор ходят легенды о якобы «вечных» луженых кузовах «Победы». Корни этой легенды таковы: ремонтируя аварийные машины, мастера использовали паяльные лампы для нагрева. И вдруг, ни с того ни с сего, из-под пламени горелки начинает «рекой» литься олово! Отсюда и пошла молва, что кузов «Победы» был полностью облужен.
На самом деле все гораздо прозаичнее. Штамповая оснастка тех лет была несовершенной, поэтому поверхности деталей получались неровными. Вдобавок тогдашние стали не годились для глубокой вытяжки, и образование морщин при штамповке стало обычным делом. Сваренный, но еще не окрашенный кузов приходилось долго готовить. Выпуклости сглаживали наждачными кругами, а вмятины заполняли оловяным припоем, особенно много которого было вблизи рамки ветрового стекла. Только и всего.
Ну, а так ли «вечен» луженый кузов, вы уже знаете: он вечен до первого хорошего удара острым камешком. А их на наших дорогах более чем достаточно.
А вот с цинком картина совсем другая. Здесь, можно сказать, мы бьем электрохимическую коррозию ее же оружием. Защищающий металл (цинк) в ряду напряжений стоит левее железа. А значит при повреждении будет разрушаться уже не сталь, а цинк. И только после того, как прокорродирует весь цинк, начнет разрушаться железо. Но, к счастью, корродирует он очень и очень медленно, сохраняя сталь на долгие годы.
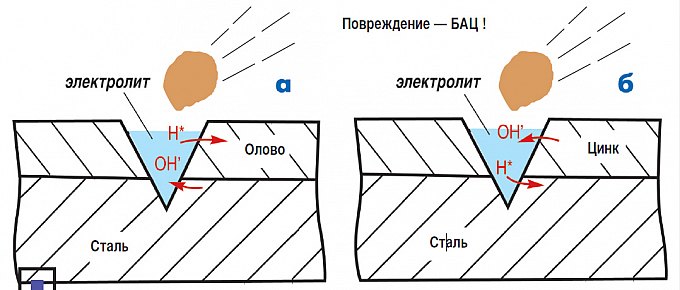 а) Коррозия луженой стали: при повреждении покрытия разрушается сталь. б) Коррозия оцинкованной стали: при повреждении покрытия разрушается цинк, защищая от коррозии сталь.
а) Коррозия луженой стали: при повреждении покрытия разрушается сталь. б) Коррозия оцинкованной стали: при повреждении покрытия разрушается цинк, защищая от коррозии сталь.
Покрытия, выполненные из более активных металлов называются «безопасными«, а из менее активных — «опасными«. Безопасные покрытия, в частности оцинковка, давно и успешно применяются как способ защиты от коррозии автомобильных кузовов.
Почему именно цинк? Ведь помимо цинка в ряду активности относительно железа более активными являются еще несколько элементов. Здесь подвох вот в чем: чем дальше в ряду активности находятся друг от друга два металла, тем быстрее разрушение более активного (менее благородного). А это, соответственно, сокращает долговечность антикоррозионной защиты
Так что для автомобильных кузовов, где помимо хорошей защиты металла важно достичь и продолжительного срока действия этой защиты, оцинковка подходит как нельзя лучше. Тем более, что цинк доступен и недорог
Кстати, а что будет, если покрыть кузов, например, золотом? Во-первых, будет ох как дорого! Но даже если золото стало бы самым дешевым металлом, такого делать нельзя, поскольку оно окажет нашей «железке» плохую услугу.
Золото ведь стоит очень далеко от железа в ряду активности (дальше всего), и при малейшей царапине железо вскоре превратится в груду ржавчины, покрытую золотой пленкой.
Автомобильный кузов подвергается воздействию как химической, так электрохимической коррозии. Но главная роль все же отводится электрохимическим процессам.
Ведь, чего греха таить, гальванических пар в автомобильном кузове много: это и сварные швы, и контакты разнородных металлов, и посторонние включения в листовом прокате. Не хватает только электролита, чтобы «включить» эти гальванические элементы.
А электролит тоже найти легко — хотя бы влага, содержащаяся в атмосфере.
Кроме того, в реальных условиях эксплуатации оба вида коррозии усиливаются множеством других факторов. Поговорим о главных из них поподробнее.
Почему коррозия называется коррозией?
Слово коррозия происходит от латинского «corrodo» – «грызу». Некоторые источники ссылаются на позднелатинское «corrosio» – «разъедание». Не следует путать понятия «коррозия» и «ржавчина». Если коррозия – это процесс, то ржавчина один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. В дальнейшем под термином «коррозия» мы будем подразумевать коррозию металлов. Согласно международному стандарту ISO 8044 под коррозией понимают физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. РЖАВЧИНА – это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной средой. В случае с металлами, говоря об их коррозии, имеют ввиду нежелательный процесс взаимодействия металла со средой.
Физико-химическая сущность изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным:
- Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- Взаимодействие среды с металлом.
- Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Известно, что большинство металлов (кроме Ag, Pt ,Cu, Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно рудами металлов. Ионное состояние более выгодно, оно характеризуется меньшей внутренней энергией. Это заметно при получении металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том, что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл, находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии. То есть можно сказать, что первопричиной коррозии является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса образуют настолько плотный и непроницаемый барьер, что коррозия прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).
Классификация видов коррозии
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
- газовая коррозия;
- атмосферная коррозия;
- коррозия в неэлектролитах;
- коррозия в электролитах;
- подземная коррозия;
- биокоррозия;
- коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
- контактная коррозия;
- щелевая коррозия;
- коррозия при неполном погружении;
- коррозия при полном погружении;
- коррозия при переменном погружении;
- коррозия при трении;
- межкристаллитная коррозия;
- коррозия под напряжением.
По характеру разрушения:
- сплошная коррозия, охватывающая всю поверхность:
- равномерная;
- неравномерная;
- избирательная;
- локальная (местная) коррозия, охватывающая отдельные участки:
- пятнами;
- язвенная;
- точечная;
- сквозная;
- межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида:
- химическую коррозию;
- электрохимическую коррозию.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Применение ингибиторов коррозии
По свойствам эти сложные химические составы делятся на две группы – средства, уменьшающие коррозионную активность внешней среды (пассиваторы) и комплексы, образующие на поверхности защищаемого изделия предохраняющий от коррозии слой адсорбирующего типа (адсорбаторы).
Кстати, для тех, кто не знает точно, чем различаются аБсорбция и аДсорбция. В первом случае это поглощение из газовой среды веществ жидкостью, во втором – поглощение веществ из той же среды поверхностным слоем твердого тела.

Очень часто ингибиторы применяют в магистралях и локальных системах отопления. В этом случае существенно уменьшается внутренняя коррозия трубопроводов и радиаторов отопления под действием теплоносителя.
Важно: в автономных замкнутых системах, работающих на дистиллированной воде, применение ингибиторов коррозии обычно не обосновано. Также ингибиторы, в сочетании с другими компонентами, используются для профилактики и очистки водопроводов, водонагревающих устройств
Также ингибиторы, в сочетании с другими компонентами, используются для профилактики и очистки водопроводов, водонагревающих устройств.
Также широко распространено применение ингибиторов в строительстве, в том числе в создании арматуры железобетонных конструкций. Обработка специальным составом препятствует коррозии арматуры в монолите и продлевает срок службы железобетона. Также сохраняется нагрузочная способность конструкции, поскольку целостность арматуры позволяет сохранять нормальный уровень сопротивления нагрузкам.

Используются ингибиторы как в виде жидкостей, так и в виде газов, вводимых в окружающую изделие среду.
1 Немного информации о коррозии металла
Обычно под коррозией металла понимают его окисление под влиянием кислот, которые присутствуют в растворах, контактирующих с металлическим изделием, либо кислорода воздуха. Коррозия наиболее часто поражает металлы, находящиеся левее водорода в так называемом ряду напряжений. Впрочем, коррозионному разрушению подвержены и многие другие материалы (неметаллические), например строительный бетон.
Коррозия возникает в результате какого-либо электрохимического или химического процесса. По этой причине ее принято подразделять на электрохимическую и химическую.
Коррозия приводит к различным разрушениям материала, которые могут быть:
- неравномерными и равномерными;
- местными и сплошными.
Если металл испытывает механические напряжения в дополнение к негативному влиянию внешней среды, наблюдается активизация (и существенная) всех коррозионных проявлений, что вызвано разрушением на поверхности изделий оксидных пленок и уменьшением показателя термоустойчивости материала.

Стоит сказать, что в некоторых случаях коррозионные процессы вызывают восстановление, а не окисление компонентов, входящих в различные металлические сплавы. Ярким примером этого является восстановление водородом содержащихся во многих сталях карбидов (такой нестандартный процесс происходит при высоких температурах и давлениях).
Экономический ущерб от коррозии
Коррозия ухудшает работу трубопроводов.
Экономические потери от коррозии металлов огромны. В США по последним данным NACE, ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Пойнт Плезант, штат Западная Виргиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виргинией и Огайо. Причиной обрушения стала коррозия.
Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Ржавеют… все!
Выше в статье упоминался такой известный центр борьбы с коррозией, как Шведский институт коррозии (ШИК) — одна из наиболее авторитетных организаций в данной области.
Раз в несколько лет ученые института проводят интересное исследование: берут кузова хорошо потрудившихся автомобилей, вырезают из них наиболее подверженные коррозии «фрагменты» (участки порогов, колесных арок, кромок дверей и т.д.) и оценивают степень их коррозионного поражения.
Важно отметить, что среди исследуемых кузовов есть как защищенные (оцинковкой и/или антикором), так и кузова без какой либо дополнительной антикоррозионной защиты (просто окрашенные детали). Так вот, ШИК утверждает, что наилучшей защитой автомобильного кузова является лишь сочетание «цинк плюс антикор»
А вот все остальные варианты, включая «просто оцинковку» или «просто антикор», по словам ученых — плохи
Так вот, ШИК утверждает, что наилучшей защитой автомобильного кузова является лишь сочетание «цинк плюс антикор». А вот все остальные варианты, включая «просто оцинковку» или «просто антикор», по словам ученых — плохи.
Есть ли надежда?
Ущерб, наносимый человечеству коррозией, колоссален. По разным данным коррозия «съедает» от 10 до 25% мировой добычи железа. Превращаясь в бурый порошок, оно безвозвратно рассеивается по белу свету, в результате чего не только мы, но и наши потомки остаемся без этого ценнейшего материала.
Но беда не только в том, что теряется металл как таковой, нет — разрушаются мосты, машины, крыши, памятники архитектуры. Коррозия не щадит ничего.
Неизлечимо больна та же Эйфелева башня — символ Парижа. Изготовленная из обычной стали, она неизбежно ржавеет и разрушается. Башню приходится красить каждые 7 лет, отчего ее масса каждый раз увеличивается на 60-70 тонн.

К сожалению, полностью предотвратить коррозию металлов невозможно. Ну, разве что полностью изолировать металл от окружающей среды, например поместить в вакуум. Но какой смысл от таких «консервированных» деталей? Металл должен работать. Поэтому единственным способом защиты от коррозии является поиск путей ее замедления.
В незапамятные времена для этого применяли жир, масла, позднее начали покрывать железо другими металлами. Прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V в. до н.э.) и римского ученого Плиния-старшего уже есть упоминания о применении олова для защиты железа от коррозии.
Интересный случай произошел в 1965 году на Международном симпозиуме по борьбе с коррозией. Некий индийский ученый рассказал об обществе по борьбе с коррозией, которое существует около 1600 лет и членом которого он является. Так вот, полторы тысячи лет назад это общество принимало участие в постройке храмов Солнца на побережье у Конарака. И несмотря на то, что эти храмы некоторое время были затоплены морем, железные балки прекрасно сохранились. Так что и в те далекие времена люди знали толк в борьбе с коррозией. Может быть, не все так безнадежно?
Что такое коррозия
Это разрушение металлов в результате воздействия на них окружающей среды. В странах с хорошо развитой промышленность ущерб от коррозии составляет 4–5% национального дохода. Портятся не только металлы, но и механизмы, и детали, изготовленные из них, что ведет к очень большим затратам. В результате ржавления трубопроводов зачастую происходит утечка вредных химических веществ, что приводит к загрязнению почвы, воды и воздуха. Все это пагубно сказывается на здоровье людей. Коррозия меди является спонтанным ее разрушением под влиянием отдельных элементов среды обитания человека. Причина порчи металла заключается в неустойчивости его к отдельным веществам, находящимся в воздухе. Скорость коррозии тем больше, чем выше температура.
Виды коррозии бетона
Хрупкость бетона может вызываться одним из трех видов коррозии. Довольно нередко встречается изменение структуры данного материала. Рассмотрим же, из-за чего это происходит.
Наиболее распространенным видом коррозии следует назвать разрушение цементного камня. Как правило, это происходит тогда, когда жидкость и атмосферные осадки постоянно воздействуют на материал. Из-за этого структура материала разрушается. Ниже есть более подробные примеры коррозии металлов:
- Взаимодействие с кислотами. Если цементный камень будет постоянно под воздействием данных материалов, то образуется довольно агрессивный элемент, который вреден для покрытия. Речь идет о бикарбонате кальция.
- Кристаллизация труднорастворимых веществ. Здесь речь идет о коррозии. Из-за того что грибки, споры и другие вещества попадают в поры, бетонное покрытие начинает быстро разрушаться.
Методы защиты от коррозии металлов
Методы защиты от коррозии металлов разделяются на технологические, активные и пассивные.
Активные методы
Методы защиты от коррозии металлов предполагают постоянное воздействие на металл, к ним относятся способы изменения коррозионной среды. Это снижение кислотности почвы, снижение содержания хлора в воде. Также к активному методу относится протекторная защита, она заключается в связывании металла с контактным материалом, который больше подвержен окислению, он называется протектором и по сути является громоотводом. Принимает на себя электролизные процессы, влияющие на ржавление металла.
Технологические приёмы
Это когда при производстве металла происходит добавление в стальной сплав хрома , титана, марганца, никеля, которые помогают получить сталь с антикоррозийными свойствами. Например при добавлении хрома на поверхности металла образуется оксидная пленка большой плотности
Пассивные методы
Происходит изолирование металла при помощи различных покрытий, которые препятствуют образованию коррозии. Применяют катодное и анодное покрытие.
Анодное покрытие
При применении анодного покрытия металл покрывают другим металлом с большим отрицательным потенциалом. Это как правило цинк, либо кадмий. В настоящее время распространена защита металла посредством нанесения слоя цинка.
Катодное покрытие
производится металлами с более положительным потенциалом. При катодном покрытии металла соблюдается механическая защита металла. В качестве катодного покрытия применяют олово медь. никель. Для покрытия металла применяют горячий метод, напыление, металлизацию, гальванизацию, При горячем методе сталь помещают в расплавленный металл, который покрывается тонким слоем. Горячий способ применяют при лужении, покрытие металла оловом, и цинкование.
Оксидирование
Также применят химические способы покрытия металла, это оксидирование, образуется оксидная пленка, которая защищает металл от коррозии, ещё этот процесс называют воронение стали. Также можно обработать сталь анодированием, это электролиз алюминия. Так же посредством фосфатирования и азотирования.
Применение эмалей и грунтов
Наиболее доступным методом защиты металла является применение специальных эмалей и грунтов.
Они осуществляют барьерную защиту от воздействия вредных факторов окружающей среды, она заключается в механической защите поверхности. Нарушение покрытия происходит при образовании микротрещин, в результате происходит возникновение подпленочной коррозии, для предотвращения проводят пассивацию поверхности металла, при помощи специальных лакокрасочных покрытий.
В состав, входят специальные химические агенты. К таким лакокрасочным покрытиям относятся грунты и эмали, имеющие в своём составе фосфорную кислоту, и другие ингибирующие элементы, замедляющие процесс коррозии. Более эффективными лакокрасочными материалами являются те которые осуществляют протекторную защиту. Это достигается путем добавления, в лакокрасочные покрытия металлов создающих донорские электронные пары, к ним относятся цинк, магний и алюминий.
Для защиты металлических конструкций, которые эксплуатируются в условиях промышленной атмосферы, разрабатываются специальные эмали, образующие, влагозащищающие уретановые покрытия. Для защиты от постоянного контакта с водной средой выпускаются эмали, способные наносится на цинк, медь и другие поверхности.
В настоящее время на рынке представлен широкий спектр антикоррозионных эмалей. Одним из новшеств является покрытие металла фторопластом, он обладает химической инертностью практически ко всем агрессивным средам. Эмали на его основе наносятся кистью, воздушным и безвоздушным распылением, на очищенную поверхность металла. При применении, того или иного материала необходимо учитывать факторы такие как вид металла условия его эксплуатации, производственные возможности и целесообразность использования.
Средства коррозионной обработки применяются в зависимости от марки металла, воздействующей среды, действующих на него нагрузок. Для каждой сферы эксплуатации конструкции предусмотрены нормативы. Оптимальным методом является, обработка металла в условиях завода. То есть нанесение, транспортировочного грунта.
Прежде чем он попадет на строительную площадку. Нанесение антикоррозионных материалов обеспечивают всего на всего 20 процентов защиты металла, основным фактором влияющим на качественную защиту металла является его предварительная обработка, от грязи . ржавчины, а также любых других веществ которые будут оказывать препятствие для окрашивания поверхности.









